
Description
Lipofectamine®3000TransfectionReagentleveragesourmostadvancedlipidnanoparticletechnologytoprovidesuperiortransfectionperformancewithimprovedapplicationoutcomesandreproducIBLeresults.ThisreagentdeliverssuperiortransfectionefficiencyandimprovedcellviABIlityforthewidestrangeofhard-to-transfectandcommoncells(e.g.,HEK293,HeLa).SuccessfullytransfectthewidestvarietyofBIOLOGicallyrelevantcelltypeswithareagentthatoffers:
•Superiorperformance—ourhighestefficiencyreagentfordifficult-to-transfectcells
•Improvedcellviability—gentleonyourcells,withlowtoxicity
•Versatile—onereagentforDNA,RNA,andco-transfection
EfficientlyTransfectDifficult-to-TransfectCells
Lipofectamine®3000reagentisdesignedtoefficientlytransfectdifficult-to-transfectcells,yieldingsuperiortransfectionperformanceacrossthebroadestarrayofcelltypes.Successfullytransfectedcelltypesinclude:
| Fibroblast(3T3,COS-7) | Myoblast(C2C12,L6CRL-1458) |
| Hepatocyte(HepG2,HuH7) | Erythroleukemiccell(K562) |
| Breastcarcinoma(MCF7,Hs578T) | Prostatecarcinoma(LNCap) |
| Lungcarcinoma(A549,NCI-H460) | Osteosarcoma(U-2OS,Saos-2) |
| Coloncarcinoma(Caco2,SW480) | Pancreaticcarcinoma(PANC-1) |
| Skinmelanoma(SK-MEL-28) |
Viewperformancedatafor60+celllinespluscomparisontoLipofectamine2000>
TransfectCommonCellsEfficientlyandCost-Effectively
Forcommoncelltypes,Lipofectamine®3000reagentismorecost-effectivethanotherreagentsduetoitshighconcentrationandlowusageamount.The1.5mLsizeprovidesupto1500transfectionreactions(in24-wellplates).
AchieveSuperiorTransfectionEfficiencyWhileMaintainingLowToxicity
Lipofectamine®3000reagentmaintainsahightransfectionefficiencywithinarobustdynamicrangeoflipiddosesforquickandeasyoptimization.Alowtoxicitylipiddose(0.75µLfor24-wellplates)issuggestedforapplicationsrequiringminimaldisruptionofthecells.
EnableHighTransfectionEfficiencyinNovelGenomeEditingApplications
Lipofectamine®3000reagentissuitablefornovelgenomeeditingapplications.ItincreasesthelikelihoodofsuccessfulcleavageandrecombinationwithTALENsorCRISPRsthroughhighlyefficienttransfection,ultimatelymaximizingtheefficiencyofgeneticmodificationsandsimplifyingthedownstreamprocesses.
Figures


Part1:BetterperformanceinanarrayofcelllinescomparedtoLipofectamine®2000reagent

Lipofectamine®3000transfectionproceduredetails

Lipofectamine®3000transfectionworkflow

EnhancedtransfectionefficiencyusingLipofectamine®3000

Part2:BetterperformanceinanarrayofcelllinescomparedtoLipofectamine®2000reagent
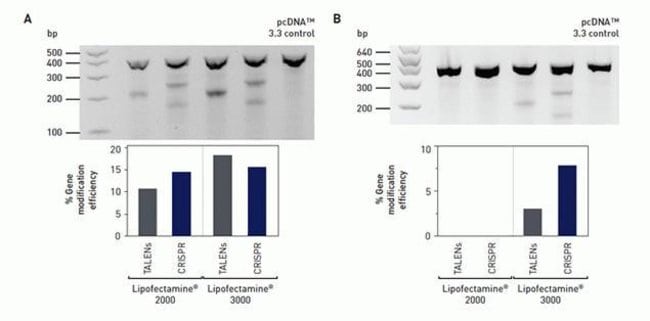
CleavageefficiencyforGeneArt®TALENsandCRISPRs

Specifications
| CellType: | EstablishedCellLines, Hard-to-TransfectCells, PrimaryCells, StemCells |
|---|---|
| SampleType(Specific): | PlasmidDNA, RNAiPlasmids(shRNA,miR), SyntheticsiRNA |
| Classification: | AnimalOrigin-Free |
| TransfectionTechnique: | Lipid-BasedTransfection |
| SerumCompatible: | Yes |
| ProductLine: | Lipofectamine® |
| ProductSize: | 0.1mL |
Contents&storage
ebiomall.com






>
>
>
>
>
>
>
>
>
>
>
>
其次要看下你选择单位的规模如何,上海这边的,你可以看下基尔顿生物,原代细胞培养,动物造模,整体课题外包。
悬浮细胞的转染方法:(以下内容转自生物帮资讯)
DXY721认为:
悬浮细胞和贴壁细胞在转染过程中差别不大,主要差别在于转染后的筛选,当然如果你做的是瞬时转染就不存在筛选的问题了。
其实转染的过程很简单,问题是能不能转的进去的,转染率能有多少,转进去是否可以稳定表达目的蛋白等等。
我们也是用脂质体做悬浮细胞的转染,说明书上都有具体的操作过程,将脂质体和目的基因按比例混合,然后加到细胞悬液里就OK了,说的简单,实际上还是有一些细节要注意的,比如脂质体和目的基因混合的比例,转染的细胞数,细胞的代数,细胞的状态,有的还要求在转染的前一天传代一次,不过不要怕,这些在脂质体说明书上都有明确的说明,按照说明书做就可以了。
jinghuanlv认为:
悬浮细胞和贴壁细胞转染还是有很大不同的。
脂质体转染的原理基于电荷吸引原理,先形成脂质体-DNA复合物,散布在细胞周围,然后通过细胞的内吞作用,将目的基因导入细胞内,而脂质体复合物与贴壁细胞的接触机会比悬浮细胞高出很多倍,所以,脂质体转染时悬浮细胞的转染效率要明显低于贴壁细胞。
我们实验室转染悬浮细胞是用的电穿孔法,目前为止,悬浮细胞转染的最好方法还是电转,我们实验室用的电转仪是Bio-Rad的,使用条件是电压250V,电容975uF,效果不错,不妨一用。
脂质体是磷脂分散在水中时形成的脂质双分子层,又称为人工生物膜。
阳离子脂质体表面带正电荷,能与核酸的磷酸根通过静电作用将DNA分子包裹入内,形成DNA一脂复合体,也能被表面带负电荷的细胞膜吸附,再通过膜的融合或细胞的内吞作用,偶尔也通过直接渗透作用,DNA传递进入细胞,形成包涵体或进入溶酶体 其中一小部分DNA能从包涵体内释放,并进入细胞质中,再进一步进入核内转录、表达。
我刚开始做转染,悬浮细胞,分别做过表达和敲减,看了很多文献,大都没有提及转染后是用转染的这同一批细胞同时做pcr,wb,cck8,凋亡,细胞周期;还是说这次转染只做pcr或wb,再转染一次做cck8或细胞周期。剩下的功能试验均同前,转染一次做一次?我养的是悬浮细胞,转染后做cck8这些功能试验前需要离心换液吗?跪谢解答!
脂质体介导法
实验原理
上图所示是脂质体介导转染的示意图,它显示了外源质粒进入细胞的一般过程。
外源基因进入细胞主要有四种方法:电击法、磷酸钙法和脂质体介导法和病毒介导法。电击法是在细胞上短时间暂时性的穿孔让外源质粒进入;磷酸钙法和脂质体法是利用不同的载体物质携带质粒通过直接穿膜或者膜融合的方法使得外源基因进入细胞;病毒法是利用包装了外源基因的病毒感染细胞的方法使得其进入细胞。但是由于电击法和磷酸钙法的实验条件控制较严、难度较大;病毒法的前期准备较复杂、而且可能对于细胞有较大影响;所以现在对于很多普通细胞系,一般的瞬时转染方法多采用脂质体法。
利用脂质体转染法最重要的就是防止其毒性,因此脂质体与质粒的比例,细胞密度以及转染的时间长短和培养基中血清的含量都是影响转染效率的重要问题,通过实验摸索的合适转染条件对于效率的提高有巨大的作用。
上图是本次实验采用的脂质体中阳离子组分的结构的示意图。
本次实验采用的脂质体是promega公司的TransFast脂质体试剂,它是一种阳离子脂质体和中性脂质体的混合物,是对于本次实验中采用的293T细胞优化的转染试剂。
目标蛋白对细胞有毒性,导致细胞死亡;
转染试剂以及DNA用量信息需要优化,否则对细胞具有伤害;
细胞贴壁转染之后没有正常换液。
建议:考虑对目标蛋白进行截短构建、尝试其他细胞系统;摸索转染试剂以及DNA用量信息,如果转染试剂毒性太大,可以考虑尝试义翘转染试剂sinofection;对转染后的细胞进行换液处理,如果细胞状态感觉不够理想,可以考虑添加一些血清来帮助细胞恢复健康。
以上所有分析、建议的前提是,细胞培养、无菌操作等等都没有问题。祝顺利,加油~


![]()
暂无品牌分类







