
Luciferaseisthegeneraltermgiventoaclassofoxidativeenzymesthatcatalyzereactionsthatgiveofflight,aprocessknownasbioluminescence.InBIOLOGy,researcherscantakeadvantageofthisreactionanduseitasareadoutforvariousbiologicalprocesses.Thishasperhapsbeenexploitedmostinluciferasereportercelllineswhereapromoterregionfromageneofinterestisplacedimmediatelyupstreamofthecodingsequenceforluciferase.Inthissystem,transcriptionalactivationofthegeneofinterestleadstoalevelofluciferaseexpressionthatisproportionaltothelevelofgeneactivation.
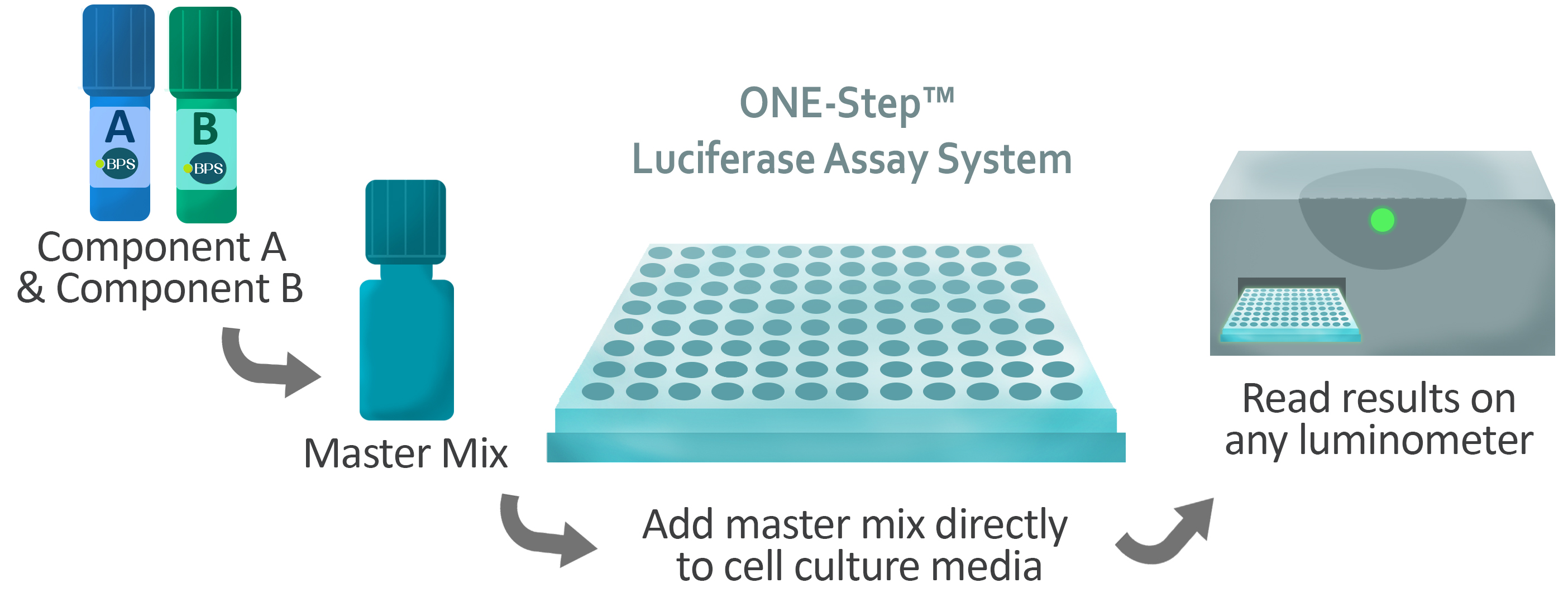
Thelevelofactivationisthenassessedbylysingthecellsandaddingtheluciferasesubstrate,D-luciferin.UsingtheOne-StepLuciferaseAssaySystemfromBPSBioscience,thisisaccomplishedinasinglestepasthelysisbufferhasbeenformulatedwithD-luciferin.Afterabriefincubationperiod,bioluminescenceisreadonaluminometer.
TheOne-StepLuciferaseAssaySystemisdesignedtobeusedforhigh-throughput,sensitivequantitationoffireflyluciferaseactivityinmammaliancellculture.Thereagentconsistsoftwocomponents,aLuciferaseReagentBuffer(ComponentA)andLuciferaseReagentSubstrate(ComponentB).ComponentAandComponentBarecombinedtoformaworkingsolutionthatcontainsallthenecessarycomponentsforcelllysisandluciferasequantitation.Thisassaysystemhasseveralfeatures:
•Sensitive–highlysensitivedetectionoffireflyluciferaseactivity.
•Stable–thesignaloutputisstableformorethantwohours,providingflexibilitywithregardtoincubationtime
•Convenient–simpleone-step,homogeneousprotocol.
•High-throughput–one-stephomogeneousprotocolminimizeshandlingstepstosupporthigh-throughputscreeningapplications
•Compatibility–workswellwithavarietyofcommonmediacontaining0-10%serumandphenolred.
•Instrumentation–doesnotrequirealuminometerwithinjectors.
COMPONENTS:
•LuciferaseReagentBuffermustbeat~roomtemperature(20-25°C)beforeuse.
•LuciferaseAssayReagentshouldbeaddedtocellsforatleast5minutesbeforemeasuringluminescencetoallowcompletecelllysis.
•Formaximallightintensity,measuresampleswithin1hourofreagentaddition.
•Avoidexposingtoexcessiveheatorlightduringincubation.
•Differentcelllinesmayexhibitvariationinlysisabilityand/orluminescencesignalandmayrequireslightoptimizationbytheend-user.
•Luminescencesignalisaffectedbyassayconditions.Resultsshouldbecomparedbetweensamplesmeasuredusingthesamecelltypeandmedia/serumcombinations.
•Toanalyzemultipleplates,includeacommoncontrolsampleineachplateandnormalizetheluminescenceofeachplatetothecontrolcontainedinthesameplate.
•Backgroundluminescenceisacharacteristicofluminometerperformance,therefore,backgroundluminescencemustbesubtractedfromallreADIngsforaccuracy.
ebiomall.com






>
>
>
>
>
>
>
>
>
>
>
>
(1)绝大多数细胞因子为分子量小于25kDa的糖蛋白,分子量低者如IL-8仅8kDa。多数细胞因子以单体形式存在,少数细胞因子如IL-5、IL-12、M-CSF和TGF-β等以双体形式发挥生物学作用。大多数编码细胞因子的基因为单拷贝基因(IFN-α除外),并由4-5个外显子和3-4个内含子组成。
(2)主要与调节机体的免疫应答、造血功能和炎症反应有关。
(3)通常以旁分泌(paracrine)或自分泌(autocrine)形式作用于附近细胞或细胞因子产生细胞本身。在生理状态下,绝大多数细胞因子只有产生的局部起作用。
(4)高效能作用,一般在pM(10-12M)水平即有明显的生物学作用。
(5)存在于细胞表面的相应高亲和性受体数量不多,在10-10000/每个细胞。细胞因子受体的研究进展相当迅速,根据细胞因子受体基因DNA序列以及受体胞膜外区氨基酸序列、同源性和结构,可分为四个类型:免疫球蛋白超家族、造血因子受体超家族、神经生长因子受体超家族和趋化因子受体。
(6)多种细胞产生,一种IL可由许多种不同的细胞在不同条件下产生,如IL-1除单核细胞、巨噬细胞或巨噬细胞系产生外,B细胞、NK细胞、成纤维细胞、内皮细胞、表皮细胞等在某些条件下均可合成和分泌IL-1。
(7)多重的调节作用(multipleregulatoryaction),细胞因子不同的调节作用与其本身浓度、作用靶细胞的类型以及同时存在的其它细胞因子种类有关。有时动物种属不一,相同的细胞因子的生物学作用可有较大的差异,如人IL-5主要作用于嗜酸性粒细胞,而鼠IL-5还可作用于B细胞。
(8)重叠的免疫调节作用(overlappingregulatoryaction),如IL-2、IL-4、IL-9和IL-12都能维持和促进T淋巴细胞的增殖。
(9)以网络形式发挥作用,细胞因子的网络作用主要是通过以下三种方式:(1)一种细胞因子诱导或抑制另一种细胞因子的产生,如IL-1和TGF-β分别促进或抑制T细胞IL-2的产生;(2)调节同一种细胞因子受体的表达,如高剂量IL-2可诱导NK细胞表达高亲和力IL-2受体;(3)诱导或抑制其它细胞因子受体的表达,如TGF-β可降低T细胞IL-2受体的数量,而IL-6和IFN-γ可促进T细胞IL-2受体的表达。
(10)与激素、神经肽、神经递质共同组成了细胞间信号分子系统。
(11)自限性分泌。向左转|向右转
单核吞噬细胞系统(mononeuclear phagocyte system)又称单核巨噬细胞系统,是高等动物体内具有强烈吞噬能力的巨噬细胞,及其前身细胞所组成的一个细胞系统,是机体防御结构的重要组成部分。
巨噬细胞细胞质内含丰富溶酶体、线粒体及粗糙内质网,细胞表面形成小突起和胞膜皱褶。静止时称固着巨噬细胞,有趋化因子时便成为游走巨噬细胞,能进行变形运动及吞噬活动。人的巨噬细胞能生活数月至数年。许多疾病能引起单核吞噬细胞系统大量增生,表现为肝、脾淋巴结肿大。功能为吞噬清除体内病菌异物及衰老伤亡细胞;活化T.B.淋巴细胞免疫反应。在细菌或其他因子刺激下能分泌酸性水解酶、中性蛋白酶、溶菌酶和其他内源性热原等。该系统包括单核细胞,结缔组织跟淋巴组织中的巨噬细胞、肝的库普佛细胞、肺的尘细胞、神经组织的小胶质细胞、骨组织的破骨细胞、表皮的朗格汉斯细胞和淋巴组织中的交错突细胞,单核细胞穿出血管壁进入其他组织中,分别分化为上述各种细胞。
细胞因子的种类:
白细胞介素(ILS)干扰素(IFN)肿瘤坏死因子(TNF)集落刺激因子(CSF)趋化因子(chemokines)生长因子(GF)
细胞因子的主要生物学作用:
① 抗感染和抗肿瘤作用。②免疫调节作用。③参与细胞凋亡。④刺激造血细胞增殖,分化。⑤促进各种细胞的生长和分化⑥参与和调节炎症反应。⑦细胞因子异常可导致疾病的发生。⑧参与神经-内分泌-免疫网络。
而对于大多数革兰阳性细菌,喹诺酮类药物主要抑制细菌的拓扑异构酶Ⅳ,拓扑异构酶Ⅳ为解链酶,可在DNA复制时将缠绕的子代染色体释放。向左转|向右转
干扰素(Interferon,IFN),是由英国科学家Isaacs于1957年利用鸡胚绒毛尿囊膜研究流感病毒干扰现象时首先发现的,是一种细胞因子,具有抑制细胞分裂、调节免疫、抗病毒、抗肿瘤等多种作用。其本质是蛋白质,类型可分为α、β、γ、ω等几种。IFN能诱导细胞对病毒感染产生抗性,它通过干扰病毒基因转录或病毒蛋白组分的翻译,从而阻止或限制病毒感染,是目前最主要的抗病毒感染和抗肿瘤生物制品。
白细胞介素、
干扰素、
肿瘤坏死因子、
生长因子、每一类里面又可以分为具体的因子。如某种细胞生长因子。
«生命的化学»2001年21卷1期
熊安琪陈松森
(中国医学科学院中国协和医科大学基础医学研究所,北京100005)
关键词:干细胞因子;c-Kit受体;细胞内信号转导
中图分类号:Q507
干细胞因子(stemcellfactor,SCF)是一种重要的造血因子,对正常造血细胞、肥大细胞、黑色素细胞、生殖细胞的增殖和分化以及肿瘤细胞的增殖和恶性演进等起着重要的调节作用。其受体是由原癌基因c-kit编码的一种具有酪氨酸激酶活性的跨膜蛋白c-Kit,分子量为117~145kD[1]。c-Kit受体由胞外结构域、单一的短跨膜区和胞内结构域三部分组成。SCF与c-Kit之间的特异性结合可触发c-Kit的同源二聚体化和其细胞膜内酪氨酸残基的磷酸化,产生停泊位点,捕获含有SH2结构域的信号分子、还能直接激活蛋白激酶C、MAP激酶、Rac1、JNK、Raf-1、JAK2等,通过多种信号因子的参与将细胞外的信号转导到细胞内部,引发某些基因的特异性表达。越来越多的研究表明:SCF/c-Kit下游的信号转录情况是非常复杂的,它是各种底物激酶的酪氨酸磷酸化和丝/苏氨酸激酶磷酸化的共同参与和整合,并且存在着许多信号转导途径之间的串话作用(cross-talking),从而精确地调控细胞的分化和增殖,其具体机制是近年来信号转导研究中的热点问题。本文对SCF/c-Kit介导的细胞内信号转导途径的研究进展作一综述(图1)。
图1SCF激活多种信号转导途径示意图(引自DianaLinnekin,1999)[2]
1.Jak/STAT信号转导途径
Jak激酶是一种非跨膜酪氨酸激酶,可以与细胞因子受体胞内区偶联,在细胞因子与受体结合后能被迅速活化,激活信号蛋白STATs,使之进核,并诱导目的基因的表达。JAK激酶家族共有4个成员:JAK1、JAK2、JAK3和TYK2。研究表明SCF可以诱导JAK2与c-Kit偶联,激活JAK2,诱导最大的细胞增殖反应。而JAK2缺陷型小鼠在子宫中死亡的胚胎发育阶段与c-Kit或SCF缺陷型小鼠相一致,进一步证明JAK2对SCF诱导的正常造血细胞的增殖、分化具有重要的影响[3]。STAT分子除了通过JAK激酶被激活外,还可以被c-Kit受体直接激活。当SCF刺激表面表达有c-Kit受体的骨髓细胞和成纤维细胞时,c-Kit胞内的不同结构域分别诱导STAT1α、STAT5A和STAT5B与之发生偶联磷酸化,而其他的STAT蛋白在SCF刺激下不能被募集活化。其中STAT1α以同源二聚体形式与c-Sis可诱导DNA元件(SIE)结合,STAT5蛋白以STAT5A/STAT5B或STAT5/STAT1α异源二聚体形式与β-酪蛋白启动子的催乳素诱导元件结合。实验研究还表明缺失激酶插入区的c-Kit缺失突变体不能激活STAT信号转导,进一步证实了c-Kit受体酪氨酸激酶活性对STAT激活的重要性[4]。
2.PI3K途径
SCF等细胞因子在刺激某些靶细胞时,可以通过c-Kit直接快速激活磷脂酰肌醇3激酶(PI3K),也能通过Shc、Rac、Ras和Rho激酶激活或增加PI3K的活性。PI3K是一种由调控亚基p85和催化亚基p110组成的异源二聚体,属多基因家族。在造血细胞中有3种p110的异构体(α、β、δ)表达,其中δ只在造血细胞中表达。当SCF与c-Kit结合时,c-Kit受体酪氨酸激酶磷酸化,在其激酶插入区第719位酪氨酸处于PI3K的p85亚基结合,使之磷酸化,激活p110催化亚基。大量的研究发现,当c-Kit第719位酪氨酸(Y)突变为苯丙氨酸(F)时,既失去了与PI3Kp85亚基偶联的能力,又丧失了SCF介导的使PI3K活性增加的能力,但Y719Fc-Kit自动磷酸化的活性没有损伤[5]。激活的PI3K又能激活下游的信号分子p70核糖体S6激酶(p70ribosomalS6kinase,p70S6K)、蛋白激酶B(PKB也叫Akt)和NF-κB[6]。Hunter等人通过构建c-KitTyr719→Phe突变的纯合体小鼠,完全阻断了c-Kit介导的PI3K信号转导途径,并且使Akt活性降低了90%。虽然该型小鼠在造血作用和黑色素生成中未表现出缺陷,但随着精原干细胞增殖减少和随后精原细胞凋亡增加,雄性小鼠精子细胞生成受阻导致不育,而该型的雌性小鼠生殖功能正常[7]。提示SCF/c-Kit信号转导途径在精子生成的生理和病理过程中起着非常重要的作用。
3.Src家族激酶
目前已发现的酪氨酸蛋白激酶Src家族的成员有:Src、Yes、Fgr、Fyn、Lck、Lyn、Blk和Hck。研究发现对SCF反应的细胞系和正常的祖细胞中都存在Lyn的高表达。用GST融合蛋白进行体外研究证明:Lyn通过SH2结构域与人c-Kit的近膜区序列568Y*VY*磷酸化酪氨酸特异性偶联磷酸化,并使其激酶活性增加,在SCF介导的细胞增殖中发挥作用。另外,Fyn也能结合相当于人c-Kit568Y*VY*磷酸化酪氨酸的多肽序列。
一种广泛表达的酪氨酸激酶Csk和与其有相似酶活性的激酶CHK(Cskhomologouskinase)可以通过磷酸化Src家族成员高度保守的C-末端酪氨酸残基而下调其活性,但对c-Kit自动磷酸化却没有明显的作用。CHK在巨核细胞、自然杀伤细胞和脑中组成型表达,SCF能够诱导CHK表达,但对Csk的表达没有影响。磷酸多肽研究提示CHK与人c-Kit第568和570位磷酸化酪氨酸发生偶联,而该位点也能与Lyn和Fyn偶联,这可能是下调SCF/c-Kit激酶活性的一种机制[8]。
另外,最新的研究发现Src家族激酶还在SCF诱导的c-Kit运输中发挥作用。正常情况下,当c-Kit与SCF结合后,该复合物快速内化,以减少细胞对SCF的反应。这种内化以及细胞受体的运输可能还是全面激活与受体偶联的信号转导通路所必需的。而Src家族激酶抑制剂PP1可以阻断SCF诱导的造血细胞表面受体c-Kit的成帽和c-Kit的内化,而c-Kit仍能与网格蛋白偶联,说明c-Kit在进入网络蛋白包被小凹过种中不依赖于Src家族激酶的作用[9]。具体的作用机制还不清楚,尚需进一步的研究。
4.Ras/Raf/MEK/ERK信号转导途径
在SCF与c-Kit结合而诱导的增殖反应中,Ras蛋白的激活是其中的一个重要环节。由SCF介导的c-Kit受体自动磷酸化能捕获多种含有SH2结构的信号分子与受体形成复合物,其中含SH2蛋白酪氨酸磷酸酶2(SHP2)和Shc的酪氨酸残基首先被磷酸化,然后偶联Grb2和Grap。Grb家族成员又与一种鸟苷转换因子Sos偶联,使Sos和Ras共定位,从而增加Ras的活性。SCF还能诱导含有SH2结构域的磷酸化酪氨酸蛋白SHIP与Shc偶联。SHIP具有5磷酸酶活性,是一种造血的负调控因子。研究还发现一种GTPase激活蛋白核因子(NF1)也参与调节SCF激活的Ras活性。
许多实验室的研究证明Raf-1这种丝/苏氨酸激酶也参与了SCF引发的磷酸酪氨酸激酶信号转导事件,在SCF的作用下其活性明显增加。SCF还能增加MEK1、MEK2和MAPK的酪氨酸磷酸化和激酶活性,再依次磷酸化并激活ERK1和ERK2[10],最后激活转录因子从而激活相应的基因,提供了一条由SCF诱导c-Kit激活引发的“级联”效应信号转导途径:Ras→Raf→MEK→ERK→其它激酶或转录因子,并且该途径的激活可以通过多种机制进行调节。
5.SCF信号转导中的负调控因子
SHP1是一种广泛表达在造血细胞内的酪氨酸磷酸酶(PTPase),对多种生长因子和细胞因子引发的有丝分裂信号进行负调控,尤其是在调节造血细胞的生长和发育过程中起着关键的作用。研究表明c-Kit与SCF结合后与SHP-1偶联发生了去磷酸化的细胞内反应[11]。鼠c-Kit受体近膜区磷酸化的569位酪氨酸是SHP-1选择性结合的主要位点,567位酪氨酸也可与之结合。对真性红细胞增多症的病因研究发现:真性红细胞增多症患者的红系祖细胞尽管在细胞因子的量和与受体的亲和力都没有增加的情况下,对几种生长因子的促有丝分裂作用却高度敏感。实验表明,近60%的患者在红细胞克隆形成单位中SHP1的表达减弱[12]。
另一种蛋白酪氨酸磷酸酶SHP2也能负调控c-Kit介导的信号转导。SCF刺激使SHP2通过567位磷酸化酪氨酸残基与c-Kit受体偶联。分别将转染的小鼠pro-B细胞系Ba/F3中c-Kit受体的567和569位酪氨酸突变为苯丙氨酸,SHP1和SHP2与c-Kit的偶联能力都显示降,细胞在SHP的作用下出现过度增殖[11]。研究表明SHPO2对红系和髓系细胞的发育具有重要的作用,它在早期造血过程中是一种正向调控因子,在进一步分化的细胞中是一种负调控因子[13]。
蛋白激酶C(PKC)也能负调控SCF介导的细胞增殖。PKC在体内和体外均可磷酸化c-Kit第741位和746位丝氨酸,突变这两个位点既提高了c-Kit的激酶活性,又促进了PI3K与c-Kit受体的偶联,从而使SCF介导的细胞增殖增加,同时降低了细胞的运动性。研究发现PKC介导的c-Kit受体丝氨酸磷酸化降低了捕获含有SH2结构域的信号分子与c-Kit偶联的能力,但不影响SCF诱导的Raf-1和ERK2的激活。
6.小结
近年来的研究证明SCF/c-Kit能够激活多种信号转导途径,而且由于许多信号分子的细胞特异性,决定了细胞内环境的复杂性和特异性,也决定了不同的生物学结果(细胞的存在、分化、增殖或凋亡)。尤其是c-Kit受体在造血系统中不同细胞系之间和不同分化阶段之间分布的差异,以及SCF与其它生长因子的协调作用,使得该信号转导途径更为复杂。这方面的研究对于我们认识各种生长因子对静止干细胞的协同作用和造血过程的一些基本问题,为从阻断或激活某些信号转导途径入手设计新型药物,具有重要理论意义和广阔的应用价值。
参考文献
[1]YardenYetal.EMBOJ,1987,6:3341-3351
[2]DianaLinnekin.TheIntJBioch&CellBiol,1999,31:1053-1074
[3]ParganasEetal.Cell,1998,93:385
[4]MariaFBetal.JBiolChem,1999,274(24):16965-16972
[5]DuronioVetal.CellSignal,1998,10:233-239
[6]DownwardJetal.CurrOpinCellBiol,1998,10:262-267
[7]Blume-JensenPetal.NatGenet,2000,24(2):157-162
[8]PriceDJetal.BiochemBiophysResCommun,1999,259(3):611-616
[9]VirginiaCetal.Blood,1999,94(6):1979-1986
[10]SuiXetal.Blood,1998,92:1142
[11]KozlowskiMetal.MolCelBiol,1998,18:2089-2099
[12]WickremaAetal.ExpHematol,1999,27(7):1124-1132
[13]QuCKetal.MolCelBiol,1998,18:6075










