前言

近日,由复旦大学王建华教授领衔,上海交通大学医学院陆劲松教授、孟祥军教授、侯照远研究员作为共同通讯作者,上海交通大学医学院王莹莹为作者,在TheJournalofClinicalInvestigation期刊发表了有关乳腺癌进展新分子机制。
JCI影响因子13.251。下面就带大家一起看一下这篇肿瘤高分文章的详细内容。
研究背景
乳腺癌是威胁女性健康的普遍的一种恶性肿瘤。目前虽然有一些针对性治疗方案,但乳腺癌仍具有较高的复发和转移,因此,阐明乳腺癌发生和进展的分子机制对于诊断和治疗将大有裨益。肿瘤的发生和进展受到肿瘤微环境的影响,特别是其中的CAF细胞(肿瘤性的成纤维细胞)。在乳腺癌中,CAF会促进恶性乳腺上皮细胞的转移。转录因子 HIC1 是一个抑癌基因,在多种肿瘤中都发现存在 HIC1 基因的表观沉默。HIC1 沉默在乳腺癌肿瘤微环境中的作用未见报道。
研究内容
研究发现,小鼠中HIC1的缺失会导致乳腺细胞的肿瘤早期恶性转化。HIC1缺失的乳腺细胞分泌趋化因子CXCL14,通过其受体GPR85激活ERK1/2、Akt和neddylationpathway,从而活化乳腺微环境中的成纤维细胞。活化的成纤维细胞反过来通过激活CCL17/CCR4趋化因子轴诱导上皮-间质转化而促进乳腺癌细胞的进展和转移。肿瘤细胞和微环境中成纤维细胞间的crosstalk在乳腺癌进展中起到了关键作用,本研究为乳腺癌的特异性诊断和治疗提供了新的思路。
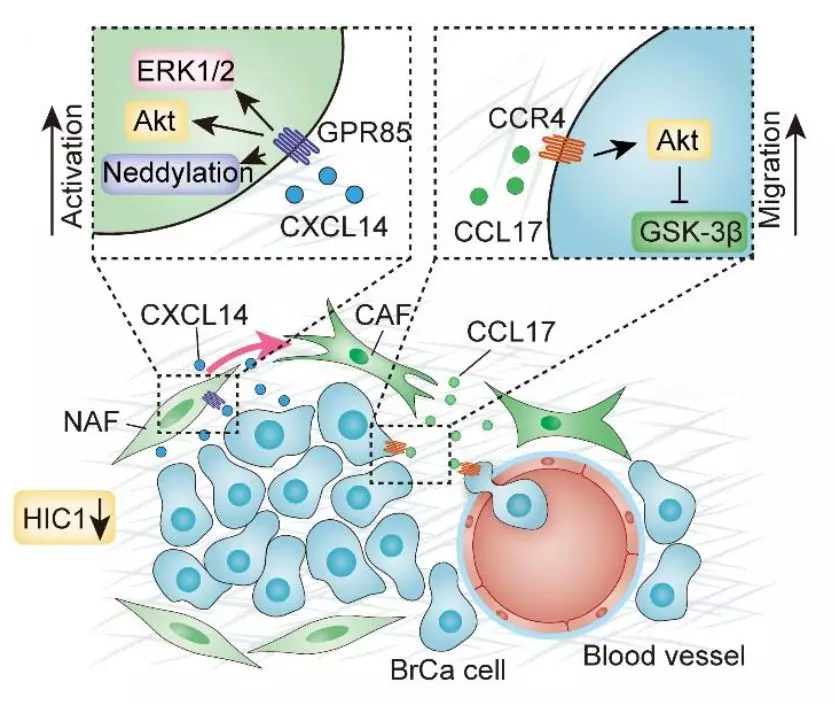
乳腺癌进展中HIC1-CXCL14-CCL17loop图
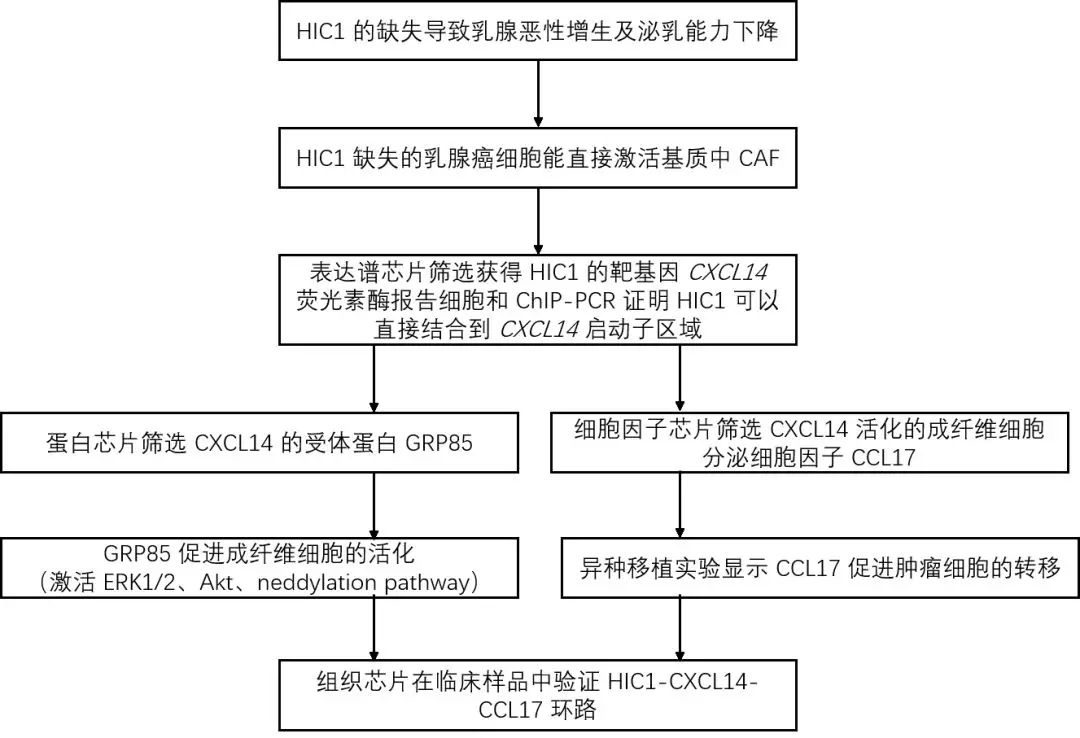
研究路线
研究结果
1、 HIC1的缺失导致乳腺恶性增生及泌乳能力下降。为研究 HIC1 缺失在乳腺癌进展中的作用,利用杂交获得 HIC1 conditionalknockout小鼠 Hic1-/-,这一小鼠在乳腺特异性的 Wap 启动子存在的情况下会发生 HIC1 deletion。与野生型 Hic1+/+ 相比,Hic1-/-小鼠乳腺导管异常增生、上皮层增厚。另外,在MCF7细胞中HIC1的缺失也会增强形成血管生成网络的能力。结果还显示,HIC1的缺失同时还会导致乳腺泌乳能力的下降。
2、 利用TCGA数据进行分析,与对照样品比较,乳腺癌样品中 HIC1 基因的表达量均出现显著下调。并且随着乳腺癌的进展,HIC1 的表达量持续下降。K-M分析也显示,HIC1的缺失对应病人更低的生存率。
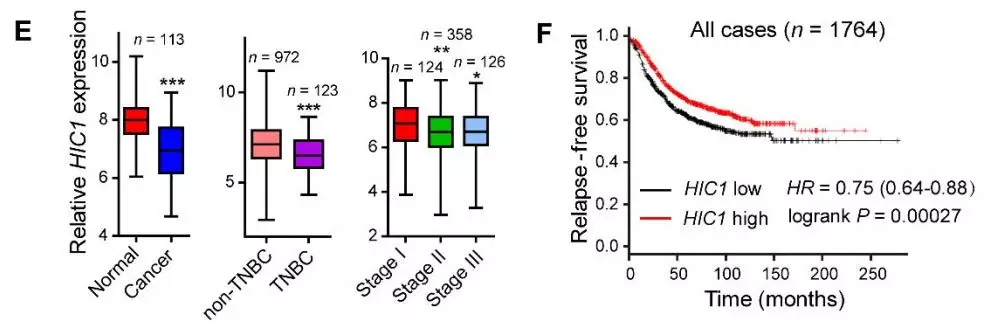
左图:HIC1 在肿瘤vs对照以及乳腺癌不同分期中的表达量;右图:HIC1与病人生存率的K-M曲线。
3、 HIC1缺失的乳腺癌细胞能直接激活基质中CAF。Westernblot检测显示,HIC1 缺失小鼠中CAFMarker基因α-SMA表达量的上调,即 HIC1 的缺失会导致乳腺基质中肿瘤性成纤维细胞CAF的活化。中同样存在CAF的活化。将正常的成纤维细胞NAF与HIC1缺失的MCF7细胞、T47D细胞分别共培养,4天后检测显示同样存在CAF的活化。

HIC1 缺失导致α-SMA上调。上图是Westerblot结果,下图是免疫荧光染色结果。
4、 CXCL14 是HIC1的靶基因。为了筛选HIC1的下游基因,利用已发表的HIC1缺失细胞系表达谱芯片数据进行挖掘,在差异表达基因中,筛选到其中8个细胞因子基因参与了乳腺成纤维细胞的活化,并通过RT-PCR进行了验证,其中趋化因子CXCL14差异显著。分析预测 CXCL14 基因启动子区域有11个HIC1-bindingsites(TGCC/GGCA),通过荧光素酶报告系统实验显示,HIC1可以直接结合到 CXCL14 的启动子区域从而调控CXCL14的表达。ChIP-PCR也证明HIC1确实可以特异性富集 CXCL14 启动子序列。
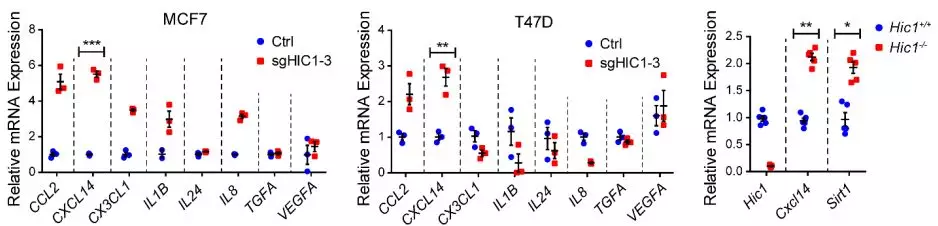
差异表达基因的检测,其中 CXCL14 在HIC1缺失组和对照组中差异显著。
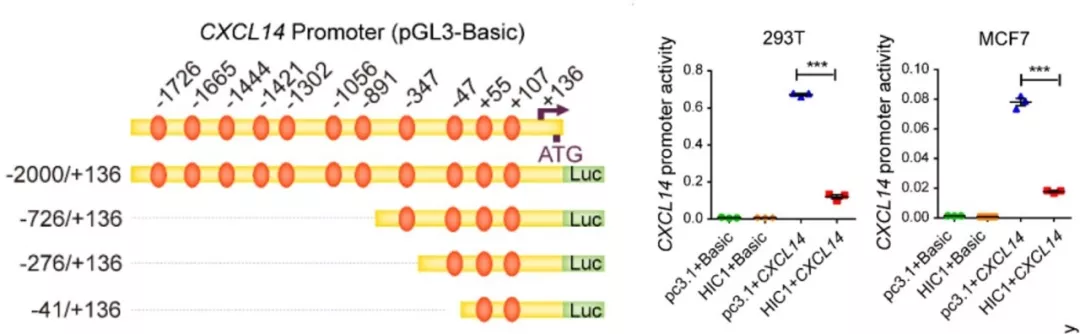
左图:CXCL14 启动子上预测的HIC1结合位点;右图:HIC1显著抑制CXCL14的表达。
5、 CXCL14参与乳腺成纤维细胞的活化。利用不同浓度的rhCXCL14处理乳腺成纤维细胞NAF,结果显示rhCXCL14处理后NAF发生显著活化(以α-SMA为检测指标)。MCF7细胞中分别敲除HIC1、HIC1和CXCL14,然后异种移植小鼠,结果显示单独敲除HIC1会增加小鼠肿瘤负荷,但同时敲除CXCL14可以挽救这一过程。利用HuProthumanproteomemicroarrays蛋白芯片筛选CXCL14互作的蛋白,最终鉴别到CXCL14的受体GPR85,CXCL14通过GPR85激活下游的ERK1/2、Akt和neddylationpathway。
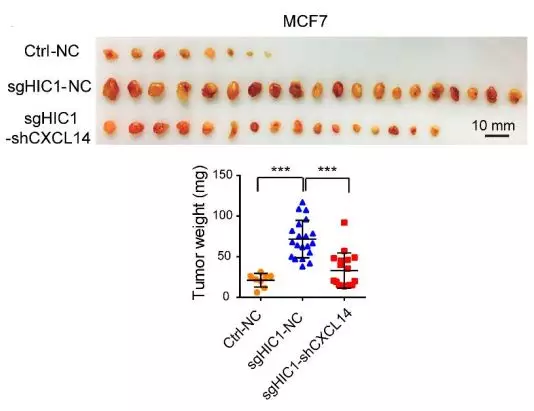
CXCL14敲除可以缓解由于HIC1敲除导致的肿瘤负荷增加。
6、 CXCL14活化的成纤维细胞通过CCL17诱导乳腺癌细胞的迁移。细胞因子芯片检测显示CXCL14活化的成纤维细胞会分泌细胞因子CCL17、IL-5和angiopoietin-2,但只有CCL17会促进乳腺癌细胞的迁移。异种移植实验也显示CCL17会导致乳腺癌细胞转移到小鼠肺部。并且rhCCL17处理会促进上皮-间质转化。CCL17也与乳腺癌病人的不良预后具有相关性。
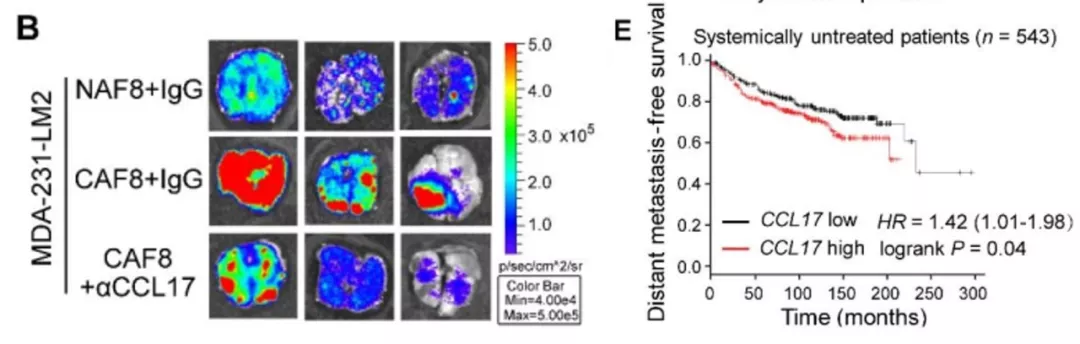
左图:CCL17促进乳腺癌细胞的肺转移;右图:CCL17与病人预后的K-M图。
7、 组织芯片验证HIC1-CXCL14-CCL17环路。为了在临床样品中验证上述发现,利用包含228例良性和恶性乳腺癌样品的组织芯片进行了检测。结果表明恶性乳腺癌样品中,上皮HIC1表达量普遍降低,而基质CXCL14、CCL17、GPR85和上皮CCR4普遍上升。并且HIC1的表达量与CXCL14、CCL17的表达量存在显著的负相关,CXCL14与CCL17的表达量存在显著的正相关(p<0.001)。

组织芯片结果图
研究结论
通过本研究,阐述了乳腺癌进展的分子机制,特别是肿瘤细胞与基质中成纤维细胞HIC1-CXCL14-CCL17loop的作用,即:乳腺细胞中HIC1的缺失会导肿瘤的早期恶性转化,乳腺癌细胞分泌细胞因子CXCL14,通过受体GPR85激活ERK1/2、Akt和neddylationpathway从而活化成纤维细胞,这些活化的成纤维细胞反过来通过激活CCL17/CCR4趋化因子轴诱导上皮-间质转化而促进乳腺癌细胞的进展和转移。
参考文献
WangY,WengX,WangL, etal.HIC1deletionpromotesbreastcancerprogressionbyactivatingtumorcell/fibroblastcrosstalk. JClinInvest 2018;doi:10.1172/JCI99974.
-END-
本文系欧易生物原创
转载请注明本文转自欧易生物







